
Dyrebare ideer må slås ned, og der satses på de gode
Pharma 08/2023 - Serie: Fra molekyle til medicin
Tredje kapitel i artikelserien ’Fra molekyle til medicin’ handler om de bekostelige kliniske forsøg, som gennemføres for at finde ud af, hvordan et lægemiddel virker, hvilke bivirkninger det har, og hvordan det omsættes i kroppen. Den seneste opgørelse viser, at Danmark ligger helt i top i EU med hensyn til igangværende kliniske forsøg. Sidste år 345 forsøg.
Af Christian K. Thorsted
Kliniske forsøg er en forudsætning for at udvikle bedre medicin og nye behandlinger, da resultaterne skal bruges til at få godkendt anvendelsen af dem. Målet med forsøgene er at afgøre, om de testede lægemidler har en positiv virkning i forhold til eksisterende behandlinger, og om de er sikre at anvende.
”Først laver virksomheden en masse laboratorie- og dyreforsøg. Hvis den her vurderer, at det nye lægemiddelstof tegner til at være både effektivt og sikkert, kan den ansøge myndighederne om at gå videre til kliniske forsøg. Men virksomheden skal være sikker på sagen, da det er en voldsom omkostning at tage et lægemiddelstof videre til de kliniske faser,” fortæller Jakob Bjerg Larsen, politisk chef for kliniske forsøg og lægemiddelproduktion, Lægemiddelindustriforeningen (Lif).
Selvom virksomheden i den prækliniske fase af lægemiddeludviklingen har screenet for effekter på specifikke mekanismer i dyr og set meget lovende resultater, så er realiteten imidlertid stadig, at kun få molekyler overlever de kliniske studier.
Ofte viser det sig, at de observerede mekanismer og effekter ikke genfindes hos mennesker. Dermed er lægemidlets kliniske fremtid stendød.
Samlet set koster fase 1- til 3-forsøgene halvdelen af de samlede omkostninger på rundt regnet en milliard dollar for et lægemiddel fra ideen i laboratoriet til det færdige, godkendte produkt (Figur 1).
Stor værdi af kliniske forsøg
Et klinisk forsøgsprogram foregår i tæt samarbejde mellem læger, lægemiddelindustri og myndigheder og kan være finansieret af private firmaer (kommerciel forskning), offentlige institutioner (non-kommerciel forskning) eller en kombination.
For virksomhedsinitierede kliniske forsøg er det lægemiddelfirmaet, der betaler udgifterne, som blandt andet består af udgifter til medicin, omkostninger i forbindelse med godkendelser af forsøget, samt arbejdskraft, undersøgelser og prøver ude på hospitalerne.
Gennemførelse af veldesignede og sikre kliniske forsøg bidrager til viden om lægemidler, og det er fundamentet for udvikling og ibrugtagning af nye lægemidler.
Forsøgene bidrager også til at udvikle kompetencerne hos det sundhedspersonale, som arbejder med dem, fordi personalet tidligt får indsigt i nye behandlingsformer og lægemidler. Det gavner patienterne direkte, der samtidig får hurtig adgang til de nyeste lægemidler.
”Samarbejdet mellem virksomheder og hospitaler om kliniske forsøg er en win-win for begge parter, som begge opnår værdifuld viden gennem forsøgene og samarbejdet. Kliniske forsøg giver patienter adgang til ny banebrydende behandling og er med til at udvikle kvaliteten i sundhedsvæsenet. De læger og sygeplejersker, der har været med til at udføre kliniske forsøg, mener især, at de er blevet bedre til at rapportere og dokumentere arbejdsgange, og at de har opnået en øget forståelse for sygdomme,” siger Jakob Bjerg Larsen.
Forskerinitieret forskning
Foruden den virksomhedsinitierede forskning foregår der på landets hospitaler og universiteter også en masse forskerinitieret forskning.
Den skaber ny viden om behandlingers kvalitet og effektivitet og understøtter den kliniske praksis til gavn for patienter, herunder danner grundlag for at afvikle de behandlinger, som giver begrænset eller ingen værdi for patienterne.
Ligeledes er den forskerinitierede kliniske forskning helt central for at sikre forskning på områder, hvor der er begrænset kommerciel interesse, og hvor der er et stort behov for at udvikle nye behandlinger, for eksempel inden for psykiatrien.
I perioden 2010-2019 er der sket en stigning på over 70 procent i den årlige danske produktion af videnskabelige publikationer inden for klinisk medicin.
Danmark øger andelen
Antallet af kliniske forsøg med lægemidler til mennesker udvikler sig positivt i Danmark.
Det fremgår af den helt nye rapport ’Anbefalinger til at styrke den kliniske forskning i Danmark’, som er lavet af en bredt sammensat arbejdsgruppe.
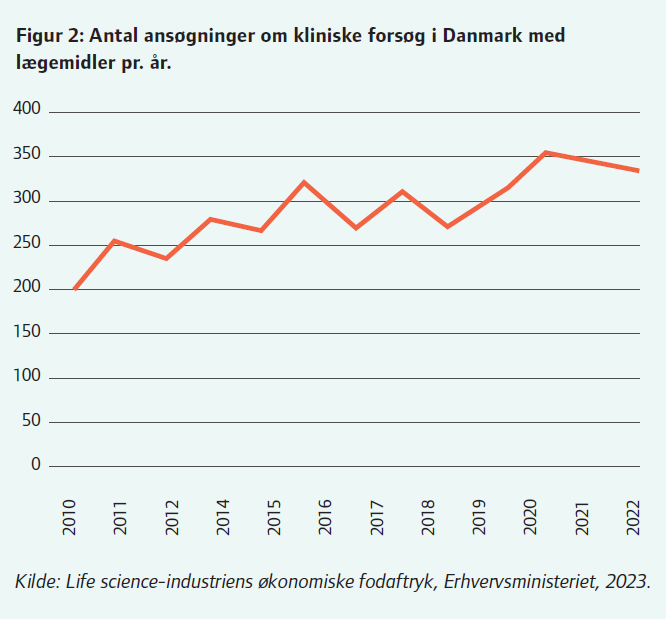
Siden 2010 har der således været en stigning i antallet af ansøgninger – fra 226 i 2010 til 345 i 2022. (Figur 2).
Stigningen er endda sket i en periode, hvor antallet af kliniske forsøg i EU er faldet med cirka 20 procent. Det betyder, at den danske andel af kliniske forsøg er steget i forhold til resten af EU-medlemslandene fra cirka 10 procent til cirka 12 procent af de samlede forsøg i EU.
Faldet i EU er del af en større tendens, hvor flere forsøg udføres i Sydøstasien. Det har blandt andet også medført, at Sydøstasien for første gang har overhalet Europa, når det handler om afholdelse af industrifinansierede kliniske studier.
I alt deltog 5.822 danske forsøgspersoner i kliniske forsøg, som virksomheder kørte i 2022.
”De globale firmaer har fået øjnene op for, at vi i Danmark ikke alene har stærke faglige miljøer i et effektivt, velfungerende og ikke mindst samarbejdsorienteret sundhedsvæsen. Vi har også en befolkning, der er åben for at deltage i forskning, og myndigheder, der ser det som et succeskriterie at bidrage til den positive udvikling,” vurderer Jakob Bjerg Larsen på baggrund af tallene.
Bevar styrkeposition
Klinisk forskning i lægemidler er altså en dansk styrkeposition, men som erhvervsminister Morten Bødskov (S) udtalte i forbindelse med offentliggørelsen af rapporten, så er det ikke nødvendigvis mejslet i sten, at det vil være sådan fremover.
Ser man på antallet af kliniske forsøg med medicinsk udstyr, kan man da også konstatere, at udviklingen hurtigt kan gå den forkerte vej: modsat for lægemidlerne er antallet af kliniske afprøvninger i Danmark nemlig her faldet med 30 procent fra 2021 til 2022; fra 34 afprøvninger til 24.
”Danmarks placering inden for klinisk forskning er med til at understrege vores internationale styrkeposition inden for life science. Men hvis vi også i fremtiden skal kunne konkurrere på øverste hylde internationalt, og samtidig skabe bedre sundhed for borgerne, er der derfor behov for, at vi løbende ser på, hvordan vi styrker rammerne for klinisk forskning,” sagde erhvervsministeren.
Et af de initiativer, der utvivlsomt allerede har gjort en forskel, er foreningen Trial Nation, som blev skabt for at lette indgangen for industrien til at gennemføre klinisk forskning i Danmark og for at gøre det mere attraktivt for virksomhederne.
Trial Nations bestyrelse er sammensat af repræsentanter fra de fem regioner, fra life-science virksomheder og ministerier, og i hver region er udpeget en regional koordinator.
Tre konkrete indsatsområder
I rapporten identificeres konkret tre centrale indsatsområder. Det omfatter blandt andet at sikre effektive administrative processer for igangsætning og gennemførelse af klinisk forskning samt at udnytte de mange muligheder, som ligger i anvendelse af nye teknologier og data i forskningsprocessen.
Ifølge arbejdsgruppen er der behov for at prioritere, at sundhedsfagligt personale kan forske, og at forskning opfattes som en naturlig del af den kliniske hverdag ligestillet med patientbehandling og uddannelse.
Samtidig er der behov for at understøtte forskere og klinikeres arbejde med at omsætte forskningsresultater til nye behandlingsmuligheder.
Styrk økosystemet
Hos Lif fremhæver Jakob Bjerg Larsen særligt, at der skal være kapacitet og incitamenter for medarbejderne til at prioritere de kliniske forsøg – både egne og i samarbejde med virksomhederne.
Derfor er det rigtigt set, at det anbefales at kigge nærmere på incitamentsforholdene, mener han. Og så er det godt, at de nye anbefalinger har et bredt sigte:
”Hele økosystemet omkring den kliniske forskning skal styrkes – ikke bare hospitalerne. Vores dygtige myndigheder skal også gives de rigtige rammer og nødvendige ressourcer, så de fortsat kan bidrage med effektiv sagsbehandling af høj kvalitet. De er også med til at tegne billedet af Danmark som et attraktivt land at placere kliniske forsøg i,” slutter han.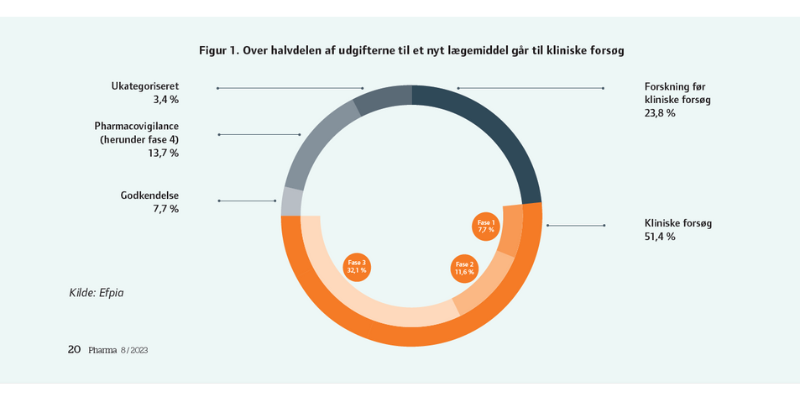
Læs den fulde artikel med yderligere information og faktabokse her.







