
Udstyr til ledsagende diagnosticering – nu og i fremtiden
Pharma 09/2022
Tidligere i år trådte den nye EU-forordning om medicinsk udstyr til in vitro-diagnostik i kraft. Det betyder, at mange, som beskæftiger sig med lægemidler, i fremtiden vil stifte bekendtskab med begrebet ’udstyr til ledsagende diagnosticering’ – bedre kendt under betegnelserne ’companion diagnostics’ eller farmakodiagnostik. Denne type diagnostiske tests spiller en central rolle i patientbehandlingen og skal derfor fremover igennem en omfattende analytisk og klinisk validering.
Af Jan Trøst Jørgensen, farmaceut, ph.d., Dx-Rx Institute
’Udstyr til ledsagende diagnosticering’ har været kendt i mere end 20 år, men først med ikrafttræden af den nye EU-forordning om medicinsk udstyr til in vitro-diagnostik i maj måned i år er det blevet en del af dansk lovgivning 1).
Ifølge forordningen defineres det som udstyr, der er afgørende for sikker og effektiv brug af et tilknyttet lægemiddel med henblik på:
a) før og/eller under behandling at identificere de patienter, som har størst sandsynlighed for at få gavn af det tilknyttede lægemiddel, eller
b) før og/eller under behandling at identificere de patienter, der sandsynligvis vil have en øget risiko for alvorlige bivirkninger som følge af behandling med det tilknyttede lægemiddel. I denne artikel vil ’udstyr til ledsagende diagnosticering’ blive omtalt som farmakodiagnostik.
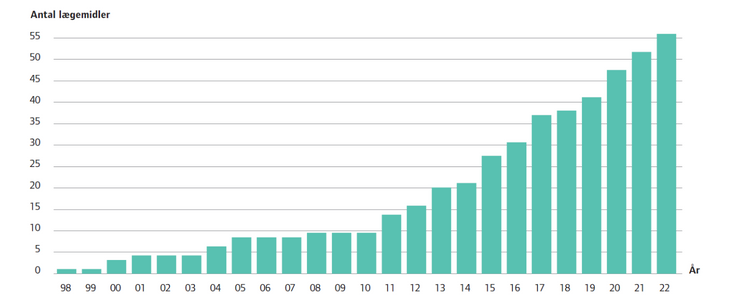
(Figur 1. Det kumulerede antal af lægemidler som er blevet godkendt med en farmakodiagnostisk test af FDA (oktober 2022).)
Prædiktive biomarkører
De farmakodiagnostiske tests er en delmængde af det, vi forstår ved prædiktive biomarkører. FDA og National Institute of Health definerer en prædiktiv biomarkør som en markør, der anvendes til at identificere personer, der er mere tilbøjelige end lignende personer uden biomarkøren til at opnå en gunstig eller ugunstig effekt som følge af behandling med et lægemiddel eller anden form for eksponering.

Første gang, vi ser et lægemiddel udviklet sammen med en farmakodiagnostisk test, er i forbindelse med det monoklonale antistof trastuzumab (Herceptin) til behandling af HER2-positiv brystkræft. Testen var et immunhistokemisk assay, der var i stand til at detektere ekspression af HER2-proteinet i tumorvævet. I forbindelse med de kliniske forsøg viste testen sig at være af afgørende betydning, da kun kvinder med høj ekspression af HER2 havde gavn af behandlingen med rastuzumab.
I 1998, da trastuzumab blev godkendt af FDA, skete det derfor sammen med det immunhistokemiske assay Hercep-Test, som dermed blev den første farmakodiagnostiske test, der opnåede en regulatorisk godkendelse.
Siden da er antallet af lægemidler, som har en farmakodiagnostisk test knyttet til deres anvendelse, steget støt, og af figur 1 kan man se, at antallet nu er på mere end 50.
Parallel udvikling af lægemiddel og farmakodiagnostisk test
Når der udvikles en farmakodiagnostisk test, sker det oftest prospektivt i et parallelforløb med lægemidlet. Hvis det her viser sig, at der er en sammenhæng mellem resultatet af den farmakodiagnostiske test og effekten af lægemidlet, vil det have stor betydning for det videre kliniske udviklingsforløb. I en sådan situation vil den farmakodiagnostiske test være i stand til at berige patientpopulationen med forsøgspersoner, der har en højere grad af sandsynlighed for et positivt udkomme.
En sådan selektion af patienter forøger styrken i det kliniske forsøg, som derfor vil kunne gennemføres med et relativt beskedent antal forsøgspersoner.
Igennem de senere år har der været udført en række succesfulde kliniske forsøg med målrettede onkologiske og hæmatologiske lægemidler, hvor antallet af forsøgspersoner har været under 200. Endda i enkelte tilfælde så lavt som 50-60 personer.
Det bemærkelsesværdige er her, at disse kliniske forsøg faktisk har ført til regulatoriske godkendelser af en række lægemidler i både USA og Europa. Det omtalte forsøgsdesign, hvor en farmakodiagnostisk test anvendes til at berige patientpopulation med mulige responderende patienter, betegnes i den engelske litteratur som ’enrichment clinical trial design’.
Farmakodiagnostik
For lægemidler, som er udviklet med en farmakodiagnostisk test, sker godkendelsen af test og lægemiddel samtidig. Det er en procedure, som FDA har fulgt i mere end 20 år, hvilket giver mening, da det er helt afgørende, at testen er tilgængelig samtidig med lægemidlet.
Den farmakodiagnostiske test er et vigtigt værktøj i behandlingsøjemed for at kunne udvælge de patienter, som vil have en mulig gavn af det givne lægemiddel. For de lægemidler, som i dag er godkendt med en farmakodiagnostisk test, vil en manglende testning oftest betyde, at de mere eller mindre vil miste deres værdi. Prævalensen af de molekylære forandringer, som detekteres med en farmakodiagnostisk test, er ofte meget lav, for eksempel for patienter med ikke-småcellet lungekræft er forekomsten af ROS1 eller ALK forandringer på henholdsvis en procent og fem procent.
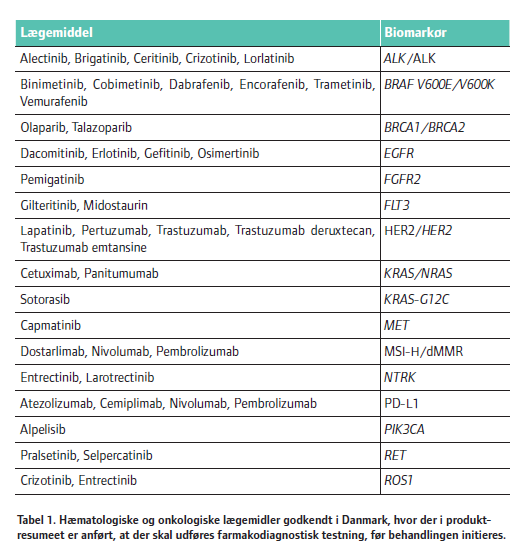
Af tabel 1 fremgår det, at tilstedeværelsen af disse biomarkører er en forudsætning for effekt af lægemidlerne som for eksempel crizotinib og alectinib. Uden en forudgående testning vil behandling med disse lægemidler både være medicinsk og økonomisk uansvarlig.
De farmakodiagnostiske tests, som i dag er myndighedsgodkendt, benytter sig af forskellige analytiske platforme/teknologier, så som ’Next Generation Sekventering’ (NGS), ’Polymerase Chain Reaction’ (PCR), ’In Situ Hybridization’ (ISH) og ’Immuno Histochemistry’ (IHC).
Lægemidler med en farmakodiagnostisk test
Brugen af farmakodiagnostiske tests er i overvejende grad udbredt blandt lægemidler til behandling af hæmatologiske og onkologiske sygdomme. Af de mere end 50 lægemidler, FDA indtil nu har godkendt sammen med en farmakodiagnostisk test, er kun to af disse til behandling af ikke maligne sygdomme, hvilket er; deferasirox til behandling af talassæmi og setmelanotid til behandling af svær overvægt.
EMA har ligeledes godkendt en lang række lægemidler, hvortil der er knyttet en farmakodiagnostisk test, og hvor det i produktresumeet fremgår, at testning er påkrævet.
Disse lægemidler og deres biomarkører er listet i tabel 1. Det skal dog nævnes, at selvom lægemidlerne er regulatorisk godkendt i Danmark, er det langt fra dem alle, hvor Medicinrådet har anbefalet dem som standardbehandlinger på landets sygehuse.
Udover de i tabel 1 nævnte lægemidler, findes der yderligere nogle få andre, som ikke tilhører de hæmatologiske og onkologiske sygdomme, og hvor testning ligeledes er påkrævet, før behandlingen initieres. Det gælder for eksempel lægemidler som abacavir, anakinra, carbamazepin, elexacaftor, fosdenopterin, ivacaftor, siponimod, tezacaftor og eliglustat.
 Regulatoriske krav til farmakodiagnostiske test
Regulatoriske krav til farmakodiagnostiske test
I USA har FDA i årevis stillet en række regulatoriske krav til de farmakodiagnostiske test. Inden de kan markedsføres, skal både den tekniske og kliniske dokumentation derfor igennem en godkendelsesproces i lighed med den, som kendes fra lægemidler. Med nogen forsinkelse har EMA også fået øjnene op for vigtigheden af den type test, og med den nye EU-forordning vil der nu også i Europa blive stillet krav til udvikling, godkendelse og anvendelse af de farmakodiagnostiske test.
Disse tests spiller en central rolle i patientbehandlingen, og inden de anvendes i klinikken, er det vigtigt, at de har gennemgået en omfattende analytisk og klinisk validering for at sikre en høj grad af pålidelighed. Falsk positive og falsk negative testsvar kan have alvorlige terapeutiske konsekvenser for den enkelte patient, hvorfor en høj grad af klinisk nøjagtighed og rigtighed, skal kunne dokumenteres.
Ifølge den nye EU-forordning tilhører de farmakodiagnostiske test risikoklasse C, hvilket betyder høj risiko for den enkelte patient og moderat risiko for folkesundheden.
Produktresuméer og pro.medicin.dk
Ved behandling af en række onkologiske og hæmatologiske sygdomme er farmakodiagnostisk testning af afgørende betydning for et korrekt terapivalg, og det er derfor vigtigt, at det klart fremgår af den information, som gives om de enkelte lægemidler, at testning er påkrævet. Ser man på de danske produktresuméer for de lægemidler, der er listet i tabel 1, er oplysningerne om testning ikke helt konsistente.
Ofte findes informationen under afsnit 4.2 ’Dosering og administration’, men for en del lægemidler er informationen kun tilgængelig i afsnit 4.4 ’Særlige advarsler og forsigtighedsregler vedrørende brugen’, hvilket ikke er optimalt.
Endnu værre står det dog til med hensyn til pro.medicin.dk. For de lægemidler, der er listet i tabel 1, kan det konstateres, at der her ingen steder er anført, at testning er påkrævet, og kun for cirka halvdelen af disse er der et direkte link til det danske produktresumé. Her synes der altså at være behov for forbedringer.
Fremtidens farmakodiagnostisk test
Igennem de sidste mere end 20 år er der gjort vigtige fremskridt i behandlingen af en række onkologiske og hæmatologiske sygdomme, og her har målrettede lægemidler kombineret med farmakodiagnostiske tests spillet en afgørende rolle. Det er en udvikling, der forventes at fortsætte de kommende år, dog med et formodentligt lidt ændret fokus.
De sidste 20 år har de genetiske biomarkører været dominerende, hvilket ikke i alle tilfælde synes at have givet et komplet billede af de molekylære ændringer, der er vigtige for et optimalt terapivalg. De genetiske informationer er absolut vigtige, men måske kun toppen af isbjerget.
Kompleksiteten stiger eksponentielt, når gener transskriberes og efterfølgende oversættes til proteiner. Det menneskelige genom indeholder mellem 20.000-25.000 kodende gener, men når det kommer til antallet af proteinmolekyler, er det formodentligt så stort som 1.000.000.
For at bygge bro mellem genotype og fænotype, og dermed yderligere optimere patientbehandlingen, er det vigtigt at kunne integrere data fra både genomet, transkriptomet og især proteomet. Integrationen af de forskellige typer data vil ske via tilpassede algoritmer.
En sådan form for ’komposit biomarkør’ vil også kunne inkludere forskellige typer af kliniske data. Indtil nu har de farmakodiagnostiske tests hovedsageligt været forbeholdt de onkologiske og hæmatologiske patienter, men vi ser nu at den type test også er i gang med at blive udviklet for lægemidler til behandling af andre alvorlige kroniske sygdomme.
1) EUROPA-PARLAMENTETS OG RÅDETS FORORDNING (EU) 2017/746 af 5. april 2017 om medicinsk udstyr til in vitro-diagnostik og om ophævelse af direktiv 98/79/EF og Kommissionens afgørelse 2010/227/EU







