
“Vi får først det fulde billede efter markedsføringen”
Pharma 09/2023 - Serie: Fra molekyle til medicin
Martin Duus Holle, Senior Safety Advisor hos LEO Pharma, har både beskæftiget sig med pharmacovigilance inden for kliniske udviklingsprojekter og den efterfølgende postmarketing overvågning af lægemidlerne. Nu ser han frem til, at det udviklingsprojekt, han er tilknyttet, udmønter sig i en godkendelse fra myndighederne og kommer på markedet. Til den tid vil der ske en bredere signaldetektion samt intensiveret rapportering til myndighederne af det nye produkt. Der er nemlig stor forskel på afprøvning i en klinisk setting og brugen ude i virkeligheden.
Af Christian K. Thorsted / Foto LEO Pharma
“Der er lagt utroligt mange kræfter i den ansøgning, som danner baggrund for myndighedernes godkendelse af et lægemiddel, men alligevel har man endnu ikke det fulde billede af, hvordan lægemidlet anvendes i klinisk praksis; derfor er det også vigtigt at overvåge lægemidlets brug og eventuelle bivirkninger efterfølgende," forklarer Martin Duus Holle, Senior Safety Advisor hos LEO Pharma, og fortsætter:
"Når man arbejder med pharmacovigilance (PV), skal man holde tungen lige i munden og vurdere, om der i eventuelt indrapporterede bivirkninger er nogle signaler, der skal reageres på. Udfordringen ligger ikke mindst i, at datakvaliteten kan være svær at vurdere, fordi indberetningerne kommer så mange steder fra; fra læger, patienter og apoteker. Der kan meget støj i det, man får ind, og det kan være svært at få yderligere information.”
Han startede som Pharmacovigilance Coordinator i Ferring – en rolle som omfattede håndtering af de bivirkninger, som globalt blev indrapporteret på virksomhedens lægemidler, herefter Associate Pharmacovigilance Manager og Pharmacovigilance Manager, hvor han analyserede på de indrapporterede data.
”Jeg havde konkret ansvaret for nogle produkter, som Ferring har haft på markedet i mange år; det ældste i over 40 år, så det var selvfølgelig produkter, hvor bivirkningsprofilen er veletableret. Men det ændrer ikke ved, at det er en overvågning, som er vigtig – der kan for eksempel være tale om signaler, der indikerer, at lægemidlet bliver brugt på en uhensigtsmæssig måde, og som vi skal reagere på,” forklarer Martin Duus Holle.
Herefter blev han kontaktet af LEO Pharma, som tilbød ham at arbejde med et andet ben af PV, safety i forbindelse med kliniske forsøg. Her beskæftiger han sig med et produkt, hvor virksomheden har indsendt en registreringsansøgning til lægemiddelmyndighederne.
Patienter er rettesnoren
Drivkraften – og baggrunden for hans valg om at arbejde inden for PV – er fagområdets fokus på patienterne, fortæller han.
”På studiet arbejdede jeg en masse i laboratoriet – jeg har også arbejdet på apotek og inden for regulatory affairs, men der var ikke noget af det, der tændte mig på samme måde som PV. Det tiltaler mig, at min rolle først og fremmest er at være garant for patientens sikkerhed – alle aspekter af mit arbejde tager udgangspunkt i, hvordan man sikrer patienterne bedst muligt. Det er supergodt at have det som rettesnor,” siger Martin Duus Holle.
Men han understreger, at business-delen for virksomheden også skal anerkendes, hvor målet jo er at få et lægemiddel på markedet, gerne så hurtigt som det kan lade sig gøre på en forsvarlig måde.
”Så det handler om at finde en balance mellem, hvordan får vi sikret, at det, vi har eller får på markedet, er så sikkert som muligt for patienterne – og at vi får kommunikeret det bedst muligt – samtidig med at det skal være salgbart. Det er udfordrende og spændende.”
Idealistisk idé om bivirkninger
Martin Duus Holle har både erfaring med postmarketing og klinisk overvågning, og han forklarer, at forskellen er stor – om end målet altså er det samme – patientsikkerhed.
”I de kliniske forsøg arbejder man efter en protokol, hvor data er bedre kontrolleret – som eksempel vil man typisk fravælge nogle grupper af patienter med for eksempel andre sygdomme ud over den, der specifikt undersøges for, for at få en realistisk idé om lægemidlets faktiske bivirkningsprofil og effektivitet. Der er med andre ord en meget større styring af de data, man får ind, ligesom kvaliteten af den er bedre. Læg dertil, at vi som sponsor af et studie har nemmere adgang til de mennesker, som genererer data. På den måde er det markant anderledes end at beskæftige sig med PV efter markedsføringen.”
I den kliniske overvågning er man også hjulpet af, at man allerede kender en del til lægemiddelkandidatens virkningsmekanismer og toksikologi, og man vil måske også kunne læne sig op ad den viden, der i øvrigt eksisterer om produktklassen og produktformuleringen. Dermed har man konturerne af en bivirkningsprofil i forvejen.
"Bivirkningsprofilen bliver dog først rigtig etableret, når man har færdiggjort de store fase III studier, der danner baggrund for den samlede pakke til myndighederne i forbindelse med, at virksomheden ansøger om markedsføringstilladelse. Når man går i submission-mode, så er kollegerne i regulatory affairs blandt de vigtigste samarbejdspartnere for PV, fordi det er dem, der har den primære kontakt til myndighederne og naturligvis er meget opmærksomme på, at dem, der skal godkende produktet, forstår rationalet og vurderingerne – hvorfor har vi vurderet, at noget er en bivirkning ved produktet, og noget ikke er."
Han fortsætter:
”Klinisk udvikling er hårdt arbejde, og der er op- og nedture. Derfor er det selvfølgelig også en stor glæde at være nået så langt som til at kunne sende en samlet dokumentationspakke ind til myndighederne. Nu har vi sørget for, at man ved mest muligt om lægemidlet, både i forhold til effektivitet og bivirkningsprofil. Derefter vil der så ligge en vigtig opgave med at overvåge brugen hos patienterne efter potentiel godkendelse, som jeg også gerne vil være en del af.”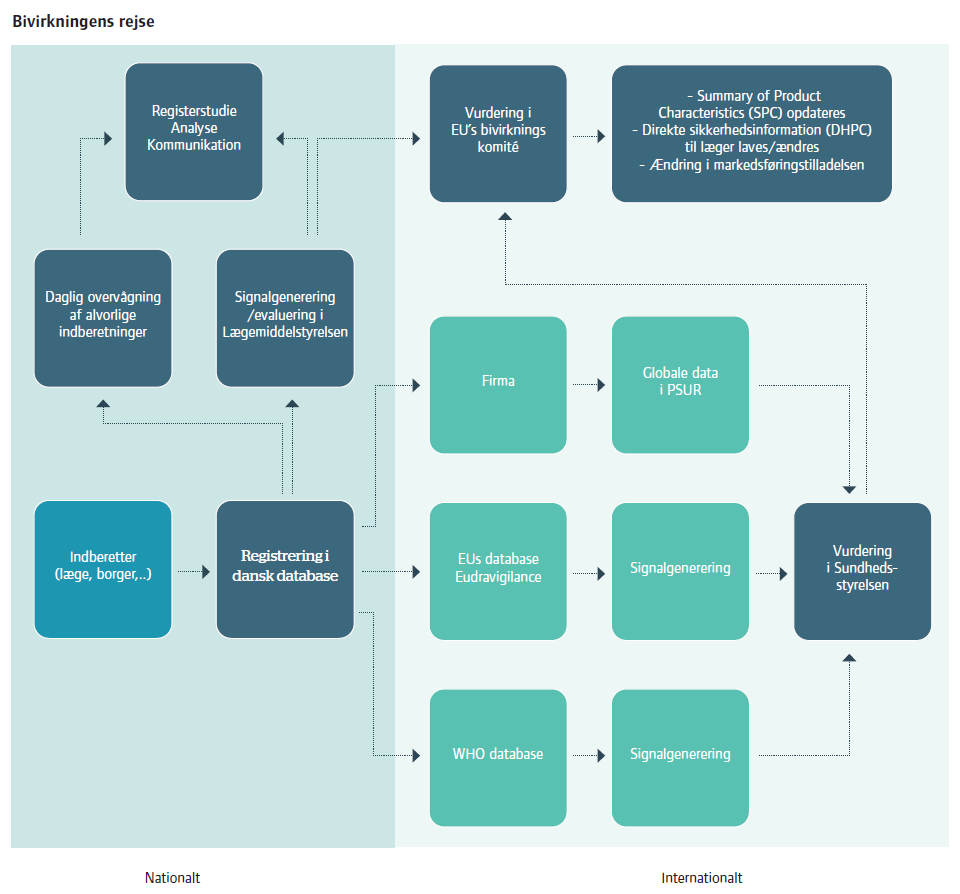
Læs de andre artikler i kapitlet Fra molekyle til medicin – regulatory affairs og pharmacovigilance:







